Le Dr Deniz Dalkara, chercheuse au laboratoire « Thérapies géniques et modèles animaux pour les maladies neurodégénératives », INSERM, CNRS, Sorbonne Université, à l’Institut de la Vision, nous livre les secrets de ses travaux de recherche en cours sur les dégénérescences rétiniennes héréditaires. Ce projet a bénéficié du soutien financier du DIM Thérapie Génique et de la Région Ile-de-France.
Pourquoi le développement d’un traitement pour les dégénérescences héréditaires de la rétine est-il si important ?
D. D : Les pathologies comme la dégénérescence maculaire liée à l’âge (DMLA) affectent 30 millions de personnes âgées dans le monde, tandis que les dégénérescences rétiniennes héréditaires, comme la rétinite pigmentaire (RP) qui rend aveugle avant l’âge de 40 ans, affecte 1,5 millions de personnes. La perte de vision est un handicap redouté. Comme les options de traitement pour les maladies dégénératives à photorécepteurs sont actuellement très limitées, il est urgent de développer de nouvelles thérapies. Cela a motivé au cours de la dernière décennie, des progrès significatifs dans la compréhension des mécanismes moléculaires et génétiques des dégénérescences rétiniennes héréditaires. Forts de ces connaissances, les chercheurs ont maintenant l’opportunité de développer de nouvelles thérapies pour le traitement de nombreuses maladies dégénératives de la rétine, en utilisant des biotechnologies de pointe telles que, la thérapie génique, la thérapie cellulaire et l’optogénétique.
Dans votre laboratoire, travaillez-vous sur l’application de ces nouvelles biotechnologies ?
D. D : Au sein de mon laboratoire à l’Institut de la Vision, nous étudions diverses approches pour développer des thérapies géniques efficaces pour le traitement des maladies dégénératives de la rétine et nous cherchons également, à créer des modèles d’études qui imitent avec précision les mécanismes moléculaires de la maladie. Dans une rétine normale, les photorécepteurs sont les cellules primaires qui détectent la lumière et développent des connexions avec d’autres cellules, pour transformer la lumière en signaux biologiques, qui sont alors transmis par le nerf optique au cerveau, permettant la reconnaissance visuelle. Chez les patients ayant perdu leurs photorécepteurs, la sensibilité à la lumière et la transmission du signal ne sont plus possibles.
Les travaux que nous avons récemment publiés (Garita-Hernandez et al., Nature Comms 2019), associent la puissance de plusieurs nouvelles biotechnologies telles que l’optogénétique en synergie avec la thérapie cellulaire, pour aider les patients ayant perdu leurs photorécepteurs à retrouver la vision. La thérapie cellulaire offre la possibilité de remplacer les photorécepteurs mourants par de nouveaux. Au laboratoire, nous sommes en mesure de générer un grand nombre de photorécepteurs de remplacement à partir de cellules souches humaines pluripotentes induites (cellules adultes qui ont été génétiquement reprogrammées à un état semblable à une cellule souche embryonnaire) et sous leurs formes différenciées ; ces cellules présentent de nombreuses caractéristiques des cellules photoréceptrices. Le problème, c’est que ces photorécepteurs de remplacement ont du mal à former les connexions (segments externes), cette partie qui les rend sensibles à la lumière et cruciale pour la transmission du signal au cerveau. De plus, même si de telles structures se forment, elles doivent être régénérées en continu pour que la phototransduction se produise. Cela apporte une difficulté supplémentaire, nécessitant une interaction entre les cellules non neuronales et les photorécepteurs.
Inutile de dire que sans ces connexions qui capturent la lumière, il n’est guère utile de greffer de nouveaux photorécepteurs dans la rétine d’un sujet aveugle. Pour restaurer la sensibilité à la lumière et la transmission de signal dans les étapes avancées des dégénérescences rétiniennes, nous nous sommes tournés vers l’optogénétique. Cette forme de thérapie génique utilise des opsines microbiennes (protéines photosensibles issues des algues) qui sont délivrées par des vecteurs viraux dans les photorécepteurs de remplacement produits au laboratoire. Ces photorécepteurs deviennent alors sensibles à la lumière. Après transplantation chez des souris aveugles, nous avons observé au laboratoire, des réponses induites par la lumière aux niveaux rétinien et comportemental provenant de la greffe. Les réponses à la lumière que nous avons enregistrées étaient caractéristiques des propriétés des opsines microbiennes insérées. Ces résultats démontrent que la réparation structurelle et fonctionnelle des photorécepteurs est possible en combinant à la fois la thérapie par cellules souches et l’optogénétique.
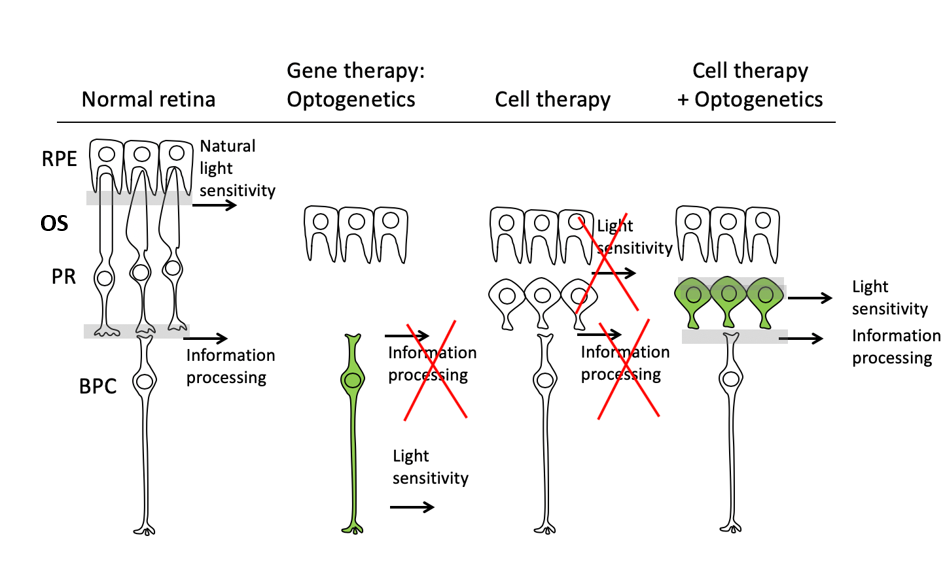
Légende : Représentation schématique du triple défi dans le remplacement des cellules photoréceptrices. Pour améliorer la vision, les photorécepteurs transplantés doivent former des segments externes fonctionnels (OS), maintenir la sensibilité à la lumière et développer des connexions avec les cellules bipolaires hôtes (BPC) pour la transmission du signal. L’optogénétique rétablit la sensibilité à la lumière dans les neurones du deuxième ou du troisième ordre de la rétine mais perd le traitement de l’information visuelle dans la rétine interne. Les photorécepteurs transplantés ne parviennent pas à développer une structure OS normale et manquent de sensibilité à la lumière. L’introduction d’une opsine microbienne hyperpolarisante dans les dérivés des photorécepteurs avant la transplantation fournit une nouvelle approche de restauration de la vision dans les étapes avancés de dégénérescence rétinienne. RPE – épithélium pigmentaire rétinien ; PR – photorécepteur ; BPC- cellules bipolaires
Pourquoi avez-vous besoin de combiner plusieurs technologies ?
D. D : Il s’agit d’une situation tellement complexe que nous avons essayé de la résoudre avec des technologies émergentes mais qui ont elles-mêmes leurs limitations. Dans notre contexte, chaque limitation peut être compensée par la versatilité d’une autre technologie. La synergie entre les différentes approches utilisées dans cette étude a également initié une importante collaboration entre les auteurs de l’étude qui viennent d’horizons différents : l’expérience en optique, électrophysiologie et circuits rétiniens du Dr Jens Dübel, du département de traitement de l’information visuelle de l’Institut de la Vision, a été complétée par mon expertise en vectorisation de gènes et thérapie génique. Le professeur Marius Ader, responsable d’équipe au CRTD / DFG-Center for Regenerative Therapies Dresden, Université technologique de Dresde en Allemagne, et le Dr Olivier Goureau, directeur de recherche de l’équipe « Développement et régénération de la rétine » à l’Institut de la Vision, ont apporté leurs connaissances sur la biologie et la transplantation des cellules souches.
Quelles sont les prochaines étapes de ce projet ? Pouvons-nous espérer de voir arriver prochainement un traitement ?
D. D : La preuve de concept de la synergie entre la thérapie cellulaire et l’optogénétique a été établie chez la souris au sein de notre laboratoire. La prochaine étape est maintenant le développement préclinique, c’est-à-dire, de tester cette approche chez les primates non humains, une étape essentielle avant d’appliquer ce traitement aux patients. Pour cela, nous avons reçu un financement de l’American National Institute of Health dans le cadre de l’initiative Audacious Goals. Nous espérons voir dans quelques années, l’application clinique de l’optogénétique pour rendre la vue aux patients atteints de dégénérescences héréditaires de la rétine.

